ProteoStat 蛋白聚集小体检测试剂盒
ProteoStat 蛋白聚集小体检测试剂盒
- 产品特性
- 相关资料
- Q&A
- 参考文献
蛋白聚集小体检测
ProteoStat® Aggresome detection kit
◆原理
聚集小体(Aggresome)是由一群不正常堆叠在一起的蛋白质所形成的包涵体(Inclusion Bodies)。聚集小体的出现往往也表明细胞正处于某种应激状态,比如高温、病毒感染、活性氧自由基攻击等。聚集体通过隔离毒性,聚集蛋白质,还可以通过自噬促进细胞代谢。提供细胞保护功能。
研究人员人文与人类疾病相关的某些细胞包涵体来自于聚集小体的反应,包括与阿尔茨海默氏病相关的细胞内外的聚集小体、与帕金森氏病的神经元相关的路易体、与酒精性肝病的干细胞相关的马洛里小体、与肌萎缩侧索硬化症(ALS)的星形胶质细胞相关透明包涵体。PROTEOSTAT®聚集小体检测试剂盒提供了一种快速、特异、定量的方法来识别一个真正的细胞环境相关的神经退行性疾病抑制剂。该固定的细胞检测不需要具备生理活性的蛋白突变体或基因工程的细胞株。PROTEOSTAT®染料已经在广泛的条件下验证,与小分子调节剂一起使用,适用于具有治疗价值的化学物的筛选。优化抗体共定位研究,确定聚集蛋白物质、自噬细胞和聚集小体的形成中涉及各种蛋白之间的相互作用。
◆试剂盒组成
|
试剂 |
包装 |
|
ProteoStar™ Aggresome Detection Reagent |
10 μl |
|
Hoechst 33342 Nuclear Stain |
50 μl |
|
Proteasome Inhibitor (MG-132) |
120 nM |
|
10X Assay Buffer |
25 ml |
◆优点・特色
1、特点
● 可靠、简便、精确的检测细胞内的蛋白质聚集反应。
● 采取了细胞固定检测方法,该方法是抗体共定位研究的优选方法。
● 可用于流式细胞实验。
● 基于细胞的灵敏的药物反应分析方法。
● 不需分离目的的蛋白或稀释样品与常规缓冲液兼容
● 在荧光微孔板中即可进行简单、灵敏、均一地检测
● 可与其他检测手段联用,获得更精确的结果
● 可检测不同蛋白的聚集
● 可检测蛋白多肽聚集程度,可用于筛选蛋白
● 与传统蛋白聚集检测染料相比更灵敏,信号更明亮
● 聚集激活剂或抑制剂
● 在宽pH(4-10)和宽离子强度范围都可使用
2、优点
● 检测样品不需要具备生理活性的蛋白突变体或基因工程的细胞株。
● 能够识别在聚集小体形成时聚集的蛋白和与其相关联的蛋白的相互作用。
● 适用于具有治疗价值的化学物的筛选。
● 首次实现了聚集小体积累的简易定量分析。
● 有助于在细胞环境中检测神经退行性疾病相关的聚集抑制剂。
◆案例・应用 本产品试用的样品请看相关资料!
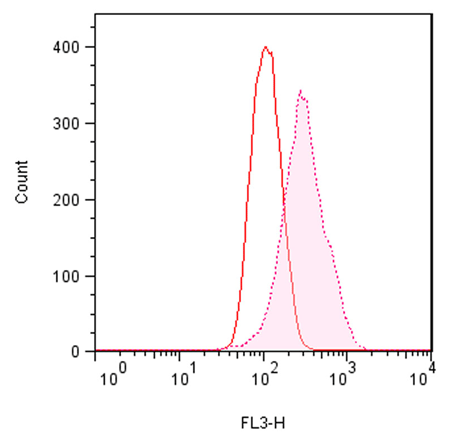
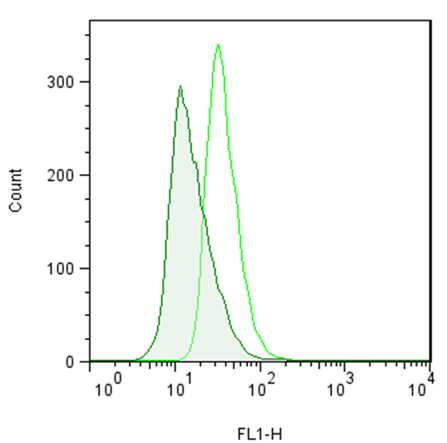
● 使用例 1:流式细胞术检测聚集小体
|
|
大动肝 |
|
| 用0.2% DMSO模拟培育Jurkat细胞或在37℃下用5µM的MG-132过夜培育。然后,用proteostat®染料孵育和固定细胞,不需清洗然后直接通过流式细胞仪,在FL3信道使用488nm的激光进行分析。在MG-132处理的细胞时,红色荧光信号增加了约3倍。上述的操作会影响蛋白质聚集小体的检测。 |
用0.2% DMSO模拟培育Jurkat细胞或在37℃下用5µM的MG-132过夜培育。用荧光素p62 Ab (1:500稀释原液)培育细胞。清洗细胞后,通过流式细胞仪在FL1信道使用488nm的激光进行分析。在MG132处理的细胞时,荧光素p62 Ab的抗体信号增加约2.5倍。 |
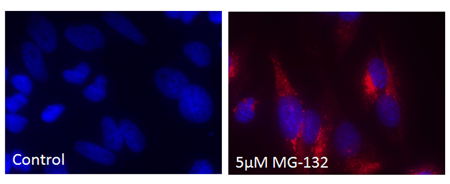
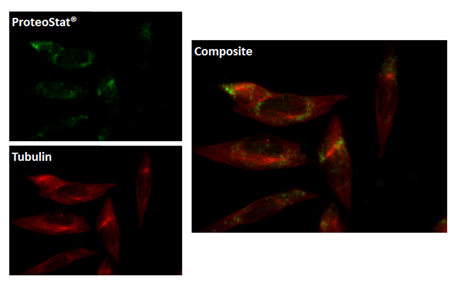
● 使用例 2:ProteoStat™ 染料与荧光染料的应用
|
用5μM MG-132培育带有HeLa细胞的聚集小体12小时后(右图),加入ProteoStat®聚集小体染料(红色)和用Hoechst33342复染,然后进行观察。未经培育的聚集小体(左图)。 |
|
|
预先用5μMMG-132培育带有HeLa细胞的聚集小体12小时后,用ProteoStat®聚集小体染料来染色观察(左上图绿色部分);与AlexaFluor®647微管蛋白抗体(左下图红色部分)共定位;通过荧光显微镜观察的合成图像(右图)。 |
|
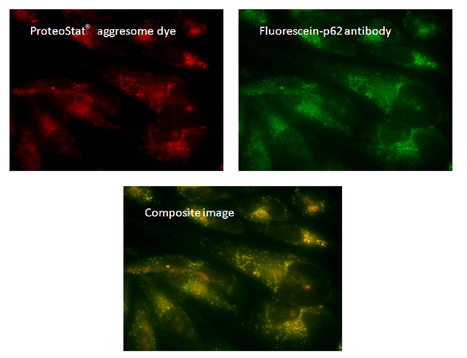
| 预先用5μMMG-132培育带有HeLa细胞的聚集小体12小时,用ProteoStat®聚集体小染料来染色观察(左上图),与荧光素p62的抗体(右上图)共定位,通过荧光显微镜观察的合成图像(下图)。 |
|
● 使用例 3
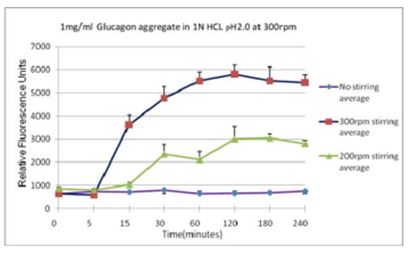
不同搅拌速率对蛋白聚集的影响使用本产品检测后,可知搅拌速度越快,蛋白聚集程度越大
● 使用例 4
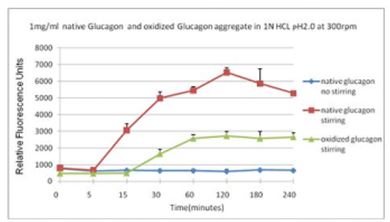
蛋氨酸被氧化后可抑制蛋白聚集蓝色曲线为对照,没有搅拌;在搅拌速度在300rpm下, 绿色曲线与红色曲线分别表示蛋氨酸被氧化后的蛋白聚集情况。使用本产品检测后,可知蛋氨酸被氧化后可抑制蛋白聚集。
● 使用例 5
|
|
|
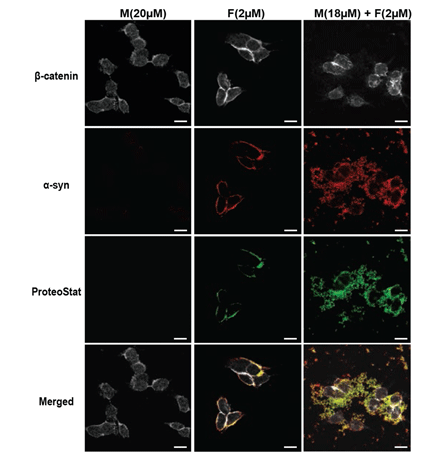
α-syn混合物形式聚集在被内化到M17神经母细胞瘤细胞系的细胞质膜。用α-syn单体处理M17细胞,声波处理α-SIGN PFFs或α-SYN混合物(M + F)。四天后,在固定M17细胞前,将其清洗3次,用 PROTEOSTAT®聚合染料(绿色)染色和用抗α-syn(红)和β连环蛋白(灰色)免疫染色。比例尺= 20µm。作者提到“Fibril生长和播种量α-synuclein蛋白介导的细胞凋亡中发挥重要作用。”此图来自A-L Mahul-Mellier, et al.; Cell Death & Differentiation (2015). (doi:10.1038/cdd.2015.79). |
● 使用例 6
|
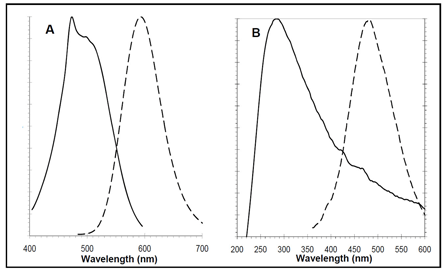
在PROTEOSTAT®聚集小体检测试剂(A)和Hoechst 33342核染色(B)的激发和发射光谱。 |
● 使用例 7
|
|
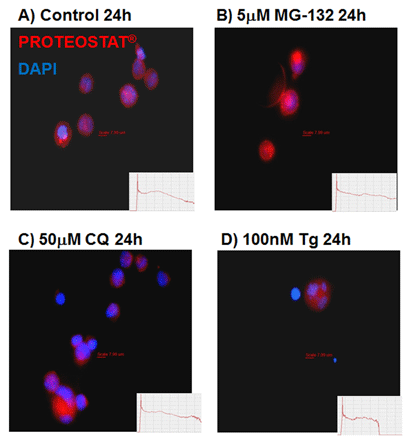
| 由内质网应激的自噬细胞产生的聚集小体和聚集小体类的包涵体,epi-荧光显微成像图。未经处理的K562细胞(A);加入5 mM MG-132溶液培育24小时(B);加入50 mM CQ培育24小时(C);加入100 nM毒胡萝卜素(D)。在温室下,用PROTEOSTAT® 染料(1:10,000稀释)来固定染色细胞30分钟。PROTEOSTAT® 的着色显示 聚集体 和 ALIS呈红色, DAPI 呈蓝色。(Courtesy of the Flow Cytometry Core Facility, Blizard Institute, Queen Mary University of London, London, UK) |
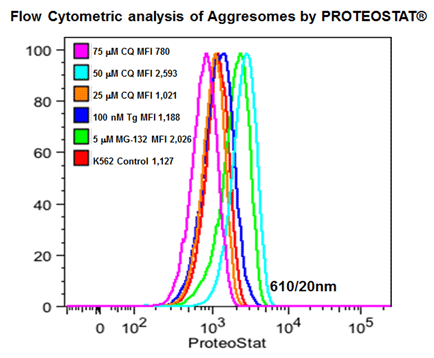
● 使用例 8 内质网应激相关的细胞自噬产生蛋白聚集小体进行流式细胞仪分析
|
|
| 分别25,50,75mmCQ,100nM的毒胡萝卜素(TG)或5mM的MG-132处理K562细胞24小时。然后在温室下用PROTEOSTAT®染料(1:10,000稀释)固定并透化培育细胞30分钟。接着在BD LSR II的蓝色610/20nm的信道分析细胞(30,000)。Courtesy of the Flow Cytometry Core Facility, Blizard Institute, Queen Mary University of London, London, UK. |
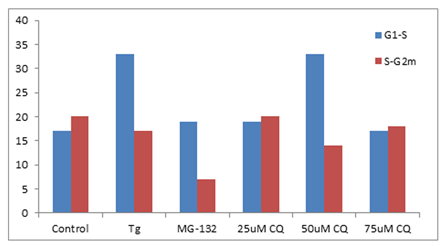
● 使用例 9
|
|
|
分别使用毒胡萝卜素(Tg,0.1微米),25,50和75微米氯喹(CQ)处理K562 细胞24小时,来诱导内质网应激和不完全自噬细胞。采用阳性对照,加入蛋白酶体抑制剂,镁 132 (5 µ M)培育 24小时。固定并透化沉淀的细胞。接着根据说明书的指示,在室温下用 300 µ l PROTEOSTAT® 聚集小体检测试剂盒 (Enzo Life Sciences)培育细胞30分钟,加入1 微克/毫升 DAPI (用来测定细胞周期)。S值聚集小体小倾向的因子(APF)相对增加,G1和G2m的S值是通过每次细胞处理后检测的结果和对照组相比而得出。S期和G1相比,ER 应激诱导剂、Tg和 50 µ M CQ的聚集小体数量呈上升趋势,同时显示蛋白酶体抑制剂,MG-132和50μMCQ下降的聚集小体数量在G2M S期比对照水平更低。Courtesy of the Flow Cytometry Core Facility, Blizard Institute, Queen Mary University of London, London, UK. |
ProteoStat®蛋白聚集检测试剂盒 Q&A
1.Q: ProteoStat®热稳定检测试剂盒(ENZ-51027),蛋白聚集检测试剂盒(ENZ-51023) 和ProteoStat®蛋白聚集检测试剂盒(ENZ-51035)的区别?
1.A: 1)ProteoStat®染料属于分子轮子染料(molecular rotor dye)。在溶液状态不发荧光(由于在中心的碳-碳单键周围的自由转动,分离了探针的不同芳香部分)。由于分子轮子染料接触到蛋白聚集体后,会封闭进入原纤维,形成β折叠,具有高强度荧光。类似于染核酸碱基的EB 一样。
1.A: 2)ProteoStat®热稳定检测试剂盒(ENZ-51027)用于直接监测热诱导蛋白变性引起的蛋白聚集,不检测蛋白非折叠而暴露的疏水部分。该试剂盒用于检测蛋白缓冲液,其他添加成分对蛋白稳定性的影响,在特定条件下多少温度时蛋白会聚集。
1. A 3)蛋白聚集检测试剂盒(ENZ-51023)用于检测液体状蛋白或者多肽形成聚集的情况。可用于确认蛋白保存的最优形态,筛选促进或者抑制蛋白聚集的试剂,检测分子伴侣的活性。与标准品或者已知浓度样品一起使用,可定量检测蛋白聚集。
1. A 4)ProteoStat®蛋白聚集检测试剂盒(ENZ-51035)检测变性蛋白,包括活细胞内聚集体或者聚集体样包涵体。ProteoStat®蛋白聚集检测染料在聚集小体形成时,接触到聚集蛋白时会变的更明亮,可用流式或者荧光显微镜检测。
2.Q: 使用ENZ-51035 时,是否可以终止并在在40℃过夜保存,第二天继续实验?
A: 建议可以在加染料前终止。荧光强度在液体中会成倍降低。而且染料与蛋白长时间孵育后,会影响蛋白聚集。
3.Q: 阳性对照染色不好。
A: 染料没有避光保存。染色时候没有避光,需要染色后立即检测。聚集蛋白不是液体。延长离心会使聚集蛋白沉淀。不要离心聚集蛋白(样品或者对照)。
4.Q: 蛋白信号饱和。
A: 蛋白样品的浓度很高。用1×Assay Buffer 稀释样品。
5.Q: 阴性对照观察到高荧光强度。
A: 样品含有干扰物质。该试剂可以与常规使用的缓冲液(PBS,Tris,HEPES)和赋形剂(海藻糖和蔗糖)使用,不过不要使用高浓度的吐温 20(比如:0.2%)
6.Q: 蛋白与ProteoStat®检测试剂结合是否是可逆的?
A: ProteoStat®检测试剂与聚集蛋白的相互作用是非供价结合。所以,理论上是可逆的。但是我们没有尝试将染料从样品中去除。
7.Q: 在药物应激检测中,细胞是否可以经胰酶消化后去检测细胞中的蛋白聚集?
A: 胰酶可以与ProteoStat®聚集检测试剂盒配套使用。细胞消化后,表面活性剂加入给细胞打孔。更大的聚集体仍然是不溶的,可以通过离心沉淀。小的聚集体通过超滤分离。表面活性剂,膜和可溶蛋白可洗掉,ProteoStat®检测试剂可用于残留蛋白。
8.Q: 在研究细胞蛋白聚集时,如何设置阳性对照?
A: MG 132 处理的细胞可作为阳性对照。
9.Q: 细胞裂解液是否可用ProteoStat®蛋白聚集检测试剂检测?
A: 检测细胞裂解液是有挑战的,表面活性剂会引起高背景。可以过滤去除表面活性剂。更大的聚集体仍然是不可溶的,可以通过离心沉淀。小的聚集体通过超滤分离。表面活性剂,膜和可溶蛋白可洗掉,ProteoStat®检测试剂可用于残留蛋白。
10.Q: ProteoStat®染料是否可以检测~300kDa 的蛋白二聚体?
A: ProteoStat®可以检测从单体到二聚体转变的蛋白,结合分子筛层析法。但是信号会变的更强烈,因为聚集体更大。
11.Q: 如果样品稀释到低浓度(比如0.5mg/mL)是否会改变聚集蛋白的百分比含量?
A: 聚集蛋白的百分比(聚集蛋白占总蛋白的比例)将保持不变。聚集蛋白的浓度会降低,信号也会减弱。如果用未聚集蛋白稀释样品,聚体蛋白的百分比会变化。
12.Q: ProteoStat®试剂盒是否可用于研究原核细胞样品的蛋白聚集?
A: 如果膜部分去除的话,是可以检测原核细胞的。如果膜没有分离,染料会聚集在膜上,引起高背景值。
13.Q: ProteoStat®是否可检测革兰氏阴性菌的蛋白聚集?
A: 革兰氏阴性菌外层膜的脂多糖会影响。操作手册中提到的打孔缓冲液将移除大多数细菌的内层膜,破坏革兰氏阴性菌的外层膜。所以可以观察革兰氏阴性菌的聚集和包涵体。
14.Q: 当其他蛋白共染时,如何优化减少FITC 发射过滤装置的信号?
A: 染料的激发和发射光谱见操作手册P8。光谱显示会与FITC 有些重叠。FITC 可以与该染料一起使用,用488nm激发波长和515nm 发射波长。如果FITC 有荧光的话就会起作用。否则,ProteoStat®染料会有溢出。建立设立一个不带有FITC 标记的抗体作为对照。另外,可用Cy5 或者Coumarin 标记的抗体解决这个问题。
|
【1】 A fast and specific method to screen for intracellular amyloid inhibitors using bacterial model systems: S. Navarro, et al.; Eur. J. Med. Chem. (2015), Application(s): Confocal microscopy, Abstract; 【2】 Amyloidogenic lysozymes accumulate in the endoplasmic reticulum accompanied by the augmentation of ER stress signals: Y. Kamada, et al.; Biochim. Biophys. Acta 1850, 1107 (2015), Application(s): Microscopy, Abstract; Conophylline protects cells in cellular models of neurodegenerative diseases by inducing mammalian target of rapamycin (mTOR)-independent autophagy: Y. Sasazawa, et al.; J. Biol. Chem. 290, 6168 (2015), Abstract; 【3】 Decreased proteasomal function accelerates cigarette smoke-induced pulmonary emphysema in mice: Y. Yamada, et al.; Lab. Invest. 95, 625 (2015), Application(s):Aggresome detection by fluorescence microscopy in fibroblasts, Abstract; 【4】Defective autophagy is a key feature of cerebral cavernous malformations: S. Marchi, et al.; EMBO Mol. Med. 7, 1403 (2015), Application(s): Aggresome detection in aggregated proteins and aggresome‐like inclusion bodies in fixed and permeabilized samples,Abstract; Full Text 【5】 Fibril growth and seeding capacity play key roles in α-synuclein-mediated apoptotic cell death: A.L. Mahul-Mellier, et al.; Cell Death Differ. 22, 2107 (2015), Abstract; 【6】 In vitro administration of gold nanoparticles functionalized with MUC-1 protein fragment generates anticancer vaccine response via macrophage activation and polarization mechanism: T. Mocan, et al.; J. Cancer 6, 583 (2015), Application(s): Aggresome detection by fluorescence microscopy in peritoneal macrophages, Abstract; Full Text 【7】 Intensified autophagy compromises the efficacy of radiotherapy against prostate cancer: M.I. Koukourakis, et al.; Biochem. Biophys. Res. Commun. 461, 268 (2015),Application(s): Fluorescence microscopy , Abstract; Mevalonate pathway regulates cell size homeostasis and proteostasis through autophagy: T.P. Miettinen, et al.; Cell Rep. 13, 2610 (2015), Application(s): Flow cytometry analysis of protein aggregation using Jurkat, U2OS, Kc167 and HUVEC cells, Abstract; 【8】 MiR-29b replacement inhibits proteasomes and disrupts aggresome+autophagosome formation to enhance the antimyeloma benefit of bortezomib: S. Jagannathan, et al.; Leukemia 29, 727 (2015), Application(s): Detection of protein aggregates by fluorescence microscopy in multiple myeloma cell lines, Abstract; Full Text 【9】 Molecular chaperone GRP78 enhances aggresome delivery to autophagosomes to promote drug resistance in multiple myeloma: M.A. Abdel Malek, et al.; Oncotarget 6, 3098 (2015), Application(s): Confocal Microscopy, Abstract; Full Text 【10】 Monitoring of dipeptidyl peptidase-IV (DPP-IV) activity in patients with mucopolysaccharidoses types I and II on enzyme replacement therapy – Results of a pilot study: K. Hetmanczyk, et al.; Clin. Biochem. (2015), Application(s): Plasma DPP-IV enzyme assay, Abstract; 【11】 Pressure overload-induced cardiac dysfunction in aged male adiponectin knockout mice is associated with autophagy deficiency: J.W. Jahng, et al.; Endocrinology 156, 1667 (2015),Abstract; Protein kinase C-dependent growth-associated protein 43 phosphorylation regulates gephyrin aggregation at developing GABAergic synapses: C.Y. Wang, et al.; Mol. Cell. Biol.35, 1712 (2015), Abstract; Schwann cells contribute to neurodegeneration in transthyretin amyloidosis: T. Murakami, et al.; J. Neurochem. 134, 66 (2015), Abstract; 【12】 Cationic polystyrene nanospheres induce autophagic cell death through the induction of endoplasmic reticulum stress: H.W. Chiu, et al.; Nanoscale 7, 736 (2014), Abstract; Direct visualization of HIV-enhancing endogenous amyloid fibrils in human semen: S.M. Usmani, et al.; Nat. Commun. 5, 3508 (2014), Application: Amyloid detection in semen,Abstract; 【13】 Distinct patterns of HSP30 and HSP70 degradation in Xenopus laevis A6 cells recovering from thermal stress: S. Khan, et al.; Comp. Biochem. Physiol. A Mol. Integr. Physiol. 168, 1 (2014), Application(s): Detection of aggresomes in Xenopus laevis cells using fluorescence microscopy, Abstract; Dynein function and protein clearance changes in tumor cells induced by a kunitz-type molecule, amblyomin-x: M.T. Pacheco, et al.; PLoS One 9, e111907 (2014), Application(s):Detection of aggresomes by flow cytometry, Abstract; Full Text 【14】 Higher vulnerability and stress sensitivity of neuronal precursor cells carrying an alpha-synuclein gene triplication: A. Flierl, et al.; PLoS One 9, e112413 (2014), Application(s):Detection of protein aggregates by fluorescence microscopy and flow cytometry in neuronal precursor cells, Abstract; Full Text 【15】Human stefin B role in cell's response to misfolded proteins and autophagy: M. Polajnar, et al.; PLoS One 9, e102500 (2014), Application(s): Detection of protein aggregates in primary astrocytes, Abstract; Full Text 【16】 Novel estradiol analogue induces apoptosis and autophagy in esophageal carcinoma cells: E. Wolmarans, et al.; Cell Mol. Biol. Lett. 19, 98 (2014), Abstract; 【17】 Preconditioning stimulus of proteasome inhibitor enhances aggresome formation and autophagy in differentiated SH-SY5Y cells: Y. Bang, et al.; Neurosci. Lett. 566, 263 (2014),Abstract; 【18】 Protein deubiquitination during oocyte maturation influences sperm function during fertilisation, antipolyspermy defense and embryo development: Y.J. Yi, et al.; Reprod. Fertil. Dev. (2014), Application(s): Detection of protein aggregates in oocytes, Abstract; 【19】 Protein expression pattern of PAWP in bull spermatozoa is associated with sperm quality and fertility following artificial insemination: C.E. Kennedy, et al.; Mol. Reprod. Dev. 81, 436 (2014), Abstract; Serine/threonine kinase 16 and MAL2 regulate constitutive secretion of soluble cargo in hepatic cells: J.G. In, et al.; Biochem. J. 463, 201 (2014), Abstract; 【20】SGTA regulates the cytosolic quality control of hydrophobic substrates: L. Wunderley, et al.; J. Cell. Sci. 127, 4728 (2014), Application(s): Dual staining with ProteoStat® dye, Abstract;Full Text 【21】 T he small heat shock protein B8 (HSPB8) confers resistance to bortezomib by promoting autophagic removal of misfolded proteins in multiple myeloma cells: M. Hamouda, et al.; Oncotarget 5, 6252 (2014), Application(s): Analysis of velcade resistant multiple myeloma human cells by WB, Assay, Abstract; Full Text 【22】Aldosterone and angiotensin II induce protein aggregation in renal proximal tubules: M.U. Cheema, et al.; Physiol. Rep. 1, e00064 (2013), Application(s): Labeling of kidney homogenates, labeled particles sorted by flow cytometry and identification by LC-MS/MS ,Abstract; Full Text 【23】Covalent and allosteric inhibitors of the ATPase VCP/p97 induce cancer cell death: P. Magnaghi, et al.; Nat. Chem. Biol. 9, 548 (2013), Application(s): Detection of aggresomes in human colon carcinoma HCT116 cells using fluorescence microscopy, Abstract; 【24】 Environmental stresses induce misfolded protein aggregation in plant cells in a microtubule-dependent manner: Y. Nakajima, et al.; Int. J. Mol. Sci. 14, 7771 (2013),Application(s): Detection of aggresomes using fluorescence microscopy, Abstract; Full Text 【25】 In vitro changes in mitochondrial potential, aggresome formation and caspase activity by a novel 17-β-estradiol analogue in breast adenocarcinoma cells: D.S. Nkandeu, et al.; Cell. Biochem. Funct. 31, 566 (2013), Abstract; Increased generation of cyclopentenone prostaglandins after brain ischemia and their role in aggregation of ubiquitinated proteins in neurons: H. Liu, et al.; Neurotox. Res. 24, 191 (2013), Abstract; 【26】 Macrolide antibiotics block autophagy flux and sensitize to bortezomib via endoplasmic reticulum stress-mediated CHOP induction in myeloma cells: S. Moriya, et al.; Int. J. Oncol.42, 1541 (2013), Application(s): Detection of aggresomes using flow cytometry, Abstract;Full Text 【27】Mst1 inhibits autophagy by promoting the interaction between Beclin1 and Bcl-2: Y. Maejima, et al.; Nat. Med. 19, 1478 (2013), Application(s): Detection of aggresomes in mouse heart sections using fluorescence microscopy, Abstract; Full Text 【28】 N-terminally truncated forms of human cathepsin F accumulate in aggresome-like inclusions: B. Jeric, et al.; Biochim. Biophys. Acta 1833, 2254 (2013), Application(s):Detection of aggresomes using fluorescence microscopy, Abstract; 【29】 The ubiquitin proteasome system regulates the stability and activity of the glucose sensor glucokinase in pancreatic beta cells: A. Hofmeister-Brix, et al.; Biochem. J. 456, 173 (2013),Abstract; Full Text 【30】 VCP Phosphorylation-Dependent Interaction Partners Prevent Apoptosis in Helicobacter pylori-Infected Gastric Epithelial Cells: C.C. Yu, et al.; PLoS One 8, e55724 (2013),Application(s): Aggresome detection in AGS human gastric epithelial cells, Abstract; Full Text 【31】 Zerumbone, an electrophilic sesquiterpene, induces cellular proteo-stress leading to activation of ubiquitin-proteasome system and autophagy: K. Ohnishi, et al.; BBRC 430, 616 (2013), Application(s): Aggresome detection in mouse hepatocytes, Abstract; 【32】Autophagy in idiopathic pulmonary fibrosis: A.S. Patel, et al.; PLoS One 7, e41394 (2012),Application(s): Detection of aggresomes in lung tissue sections using fluorescence microscopy, Abstract; Full Text 【33】 Decreased proteasomal activity causes age-related phenotypes and promotes the development of metabolic abnormalities: U. Tomaru, et al.; Am. J. Pathol. 180, 963 (2012),Abstract; 【34】 Mutations in the area composita protein αT-catenin are associated with arrhythmogenic right ventricular cardiomyopathy: J. van Hengel, et al.; Eur. Heart J. 34, 201 (2012),Abstract; 【35】 Quantitative analysis of α-synuclein solubility in living cells using split GFP complementation: A. Kothawala, et al.; PLoS One 7, e43505 (2012), Application(s):Aggresome detection in HeLa cells, Abstract; Full Text 【36】 Multiple aggregates and aggresomes of C-terminal truncated human αA-crystallins in mammalian cells and protection by αB-crystallin: I. Raju, et al.; PLoS One 6, e19876 (2011), Application(s): Aggresome detection in HeLa cells, Abstract; Full Text 【37】 Novel Cell- and Tissue-Based Assays for Detecting Misfolded and Aggregated Protein Accumulation Within Aggresomes and Inclusion Bodies: D. Shen, et al.; Cell Biochem. Biophys. 60, 173 (2011), Abstract; Full Text 【38】Inhibitors of protein aggregation and toxicity: H. Amijee, et al.; Biochem. Soc. Trans. 37, 692 (2009), Abstract; Full Text 【39】Autophagy-mediated clearance of aggresomes is not a universal phenomenon: E. Wong, et al.; Hum. Mol. Genet. 17, 2570 (2008), Abstract; Full Text 【40】Chemical and biological approaches synergize to ameliorate protein-folding diseases: T.W. Mu, et al. ; Cell 134, 769 (2008), Abstract; Full Text 【41】Inhibitors of the proteasome suppress homologous DNA recombination in mammalian cells: Y. Murakawa, et al.; Cancer Res. 67, 8536 (2007), Abstract; 【42】 p62SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death: G. Bjørkøy, et al.; J.Cell Biol. 171, 603 (2005), Full Text 【43】Therapeutic effects of cystamine in a murine model of Huntington's disease: A. Dedeoglu, et al.; J. Neurosci. 22, 8942 (2002), Full Text |
| 产品编号 | 产品名称 | 产品规格 | 产品等级 | 产品价格 |
| ENZ-51035-K100 | ProteoStat® Aggresome detection kit ProteoStat®蛋白聚集小体检测试剂盒 |
100tests | – | – |
| ENZ-51035-0025 | ProteoStat® Aggresome detection kit ProteoStat®蛋白聚集小体检测试剂盒 |
25tests | – | – |